Une équipe de chercheurs français affiliés à l’Institut Curie, au CNRS et à l’Inserm annonce avoir conçu une nouvelle classe de petites molécules capables d’induire la mort des cellules cancéreuses à fort potentiel métastatique, principales responsables des récidives et de 70 % des décès par cancer. C’est ce que rapportent les institutions dans un communiqué publié à l’occasion de la parution de ces travaux dans la revue Nature.
Les traitements oncologiques actuels ciblent majoritairement les cellules tumorales primaires à prolifération rapide. En revanche, les cellules cancéreuses dites « persistantes », caractérisées par leur plasticité et leur potentiel de dissémination métastatique, parviennent à résister aux chimiothérapies classiques. Ces cellules expriment notamment la protéine CD44, qui facilite l’internalisation du fer et favorise leur agressivité.
Les chercheurs ont tiré parti de cette propriété pour activer un processus de mort cellulaire peu exploité jusqu’à présent : la ferroptose. Ce mécanisme repose sur une réaction catalysée par le fer dans les lysosomes, induisant une oxydation en chaîne des lipides membranaires, jusqu’à la dégradation complète des compartiments intracellulaires. L’équipe dirigée par Raphaël Rodriguez a mis au point des composés appelés dégradeurs de phospholipides, qui exploitent ce mécanisme en ciblant d’abord la membrane plasmique, avant de s’accumuler dans les lysosomes par endocytose.
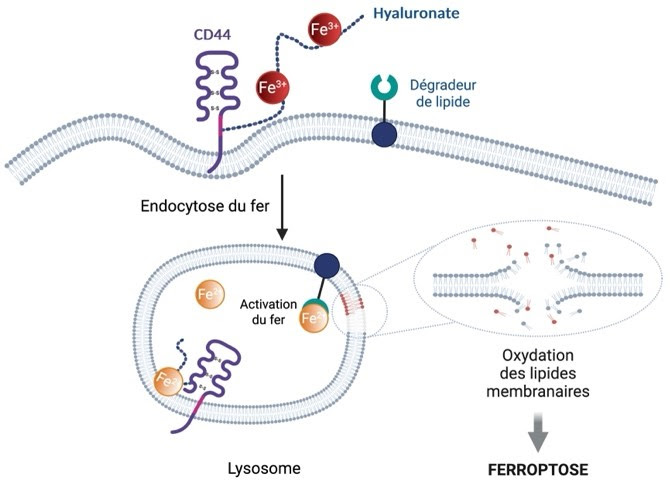
Parmi ces molécules, la fentomycine (Fento-1), conçue pour être fluorescente, a permis aux chercheurs de suivre précisément son accumulation lysosomale par microscopie. Une fois à l’intérieur de la cellule, elle exacerbe la réactivité du fer avec le peroxyde d’hydrogène, générant des radicaux oxygénés hautement toxiques pour les membranes cellulaires. Cette cascade aboutit à la mort de la cellule cancéreuse par ferroptose.
Dans des modèles précliniques de cancer du sein métastatique, l’administration de Fento-1 a permis une réduction significative de la croissance tumorale. Des tests ex vivo sur des biopsies humaines de cancers du pancréas et de sarcomes ont confirmé l’effet cytotoxique du composé, alors que ces types tumoraux restent particulièrement réfractaires aux chimiothérapies actuelles. Les chercheurs notent également une bonne tolérance du traitement chez l’animal, après injection lymphatique.
Les auteurs soulignent toutefois que des essais cliniques seront nécessaires pour valider l’efficacité de cette approche thérapeutique chez l’humain. Si elle se confirme, l’activation ciblée de la ferroptose pourrait constituer une voie complémentaire aux stratégies existantes pour éliminer les cellules cancéreuses métastatiques.
Ces travaux ont été soutenus par de nombreux partenaires, dont la Ligue contre le cancer, l’ERC dans le cadre du programme Horizon 2020, la Fondation pour la recherche médicale, l’Institut national du cancer, l’ANR et plusieurs fondations privées.