L’une des principales avancées dans le traitement du cancer du sein HER2+ est sans aucun doute le développement d’anticorps monoclonaux tels que le trastuzumab et le bévacizumab, qui visent très précisément les cibles thérapeutiques, tout en restant coûteux pour la Sécurité Sociale. Dès lors, aucun prestataire de soins ne remet en question les opportunités liées au développement des biosimilaires, variantes meilleur marché des protéines thérapeutiques.
Le trastuzumab définit certes de nouvelles normes thérapeutiques, mais…
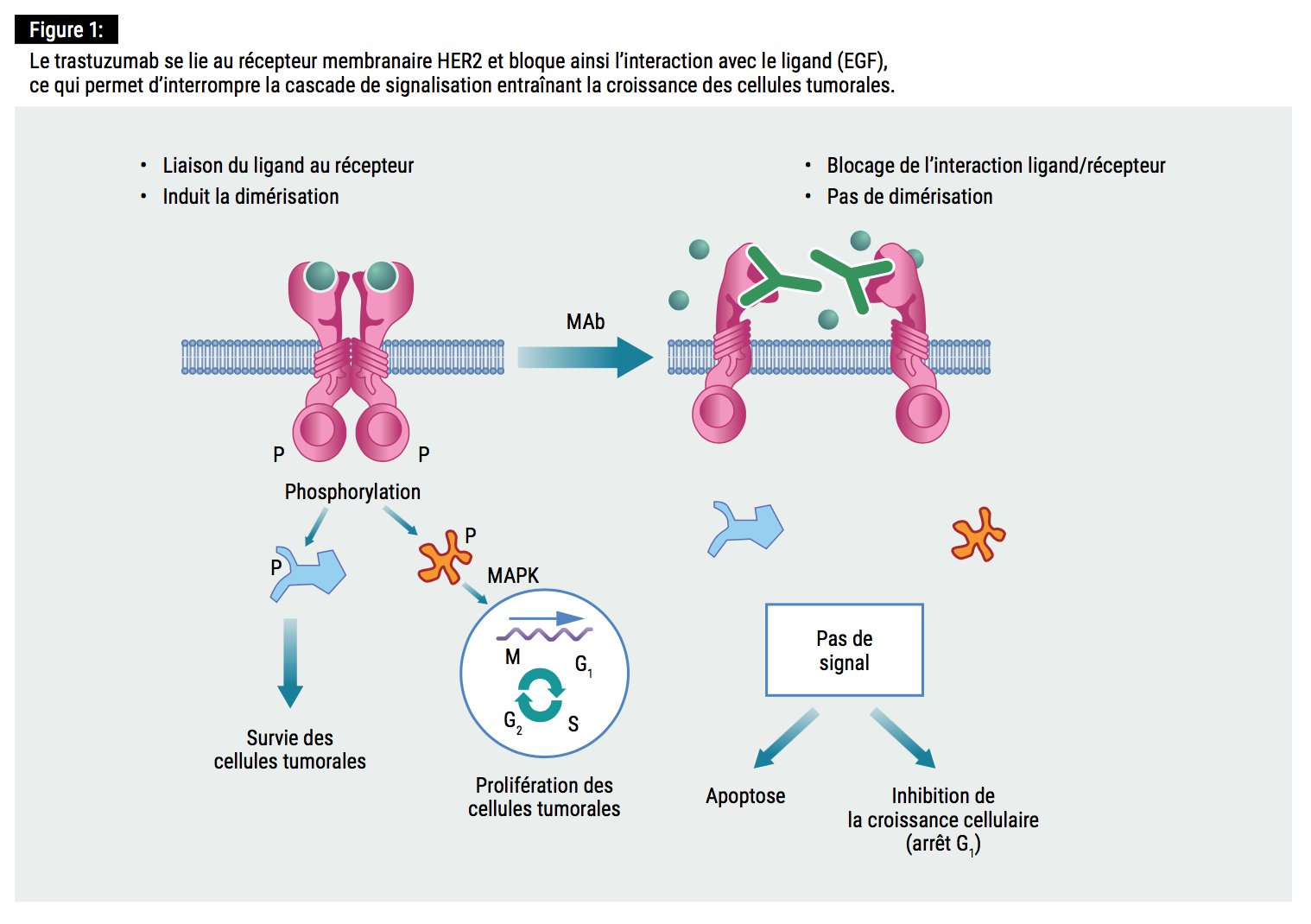
Bien qu’au cours de la dernière décennie, la mortalité associée au cancer du sein ait chuté de manière significative, essentiellement grâce à l’exploration de nouvelles pistes thérapeutiques, ce cancer reste l’un des plus meurtriers à l’échelle mondiale (1). Dans le cancer HER2+, le gène codant pour le récepteur 2 du facteur de croissance épidermique (HER2) est amplifié, entraînant une surexpression pathologique de la protéine HER2, ce qui déclenche une croissance cellulaire non contrôlée. Le trastuzumab (Herceptin®), un anticorps monoclonal humanisé recombinant, cible cette protéine membranaire HER2, qui interagit avec le facteur de croissance épidermique (EGF) et inhibe de cette manière la cascade de signalisation conduisant à la croissance et à la différenciation cellulaires (à l’origine de la formation de la tumeur) (2).
En 2000, le trastuzumab a reçu l’approbation de l’EMA pour le traitement du cancer du sein HER2+ métastatique. Un an plus tard, il était approuvé comme traitement non adjuvant et adjuvant pour le cancer du sein HER2+ à un stade précoce (3). Désormais, personne ne niera que le trastuzumab a défini de nouvelles normes thérapeutiques pour le traitement des patientes atteintes d’un cancer du sein HER2+ à un stade précoce ou avancé, et cet anticorps monoclonal figure aujourd’hui sur la liste des médicaments essentiels de l’OMS.
… le coût du traitement reste élevé
Bien que le trastuzumab soit désormais devenu le traitement standard pour les patientes souffrant d’un cancer
du sein HER2+ précoce ou avancé, il convient de ne pas occulter les résultats des études dans la pratique, à savoir que 12 à 50% de ces patientes (aux États-Unis, en Europe et en Chine) n’ont pas reçu de trastuzumab lors (de certaines phases) du trajet thérapeutique (4). Les raisons sont sans aucun doute multifactorielles. Cela peut dépendre du contexte clinique précis et des populations de patientes, mais de nombreux prestataires de soins sont d’avis qu’il n’est pas rare que le coût du trastuzumab ait été l’un des obstacles déterminants.
Dans ce contexte, il convient de souligner que le brevet du trastuzumab en Europe a expiré depuis 2014 et qu’il expirera en 2019 aux États-Unis, ouvrant de nouvelles perspectives pour le développement de biosimilaires. Rappelons que les biosimilaires sont des produits biologiques réputés équivalents à la protéine thérapeutique (ce qui ne signifie pas identiques).
Biosimilaires du trastuzumab
pour le cancer du sein HER2+
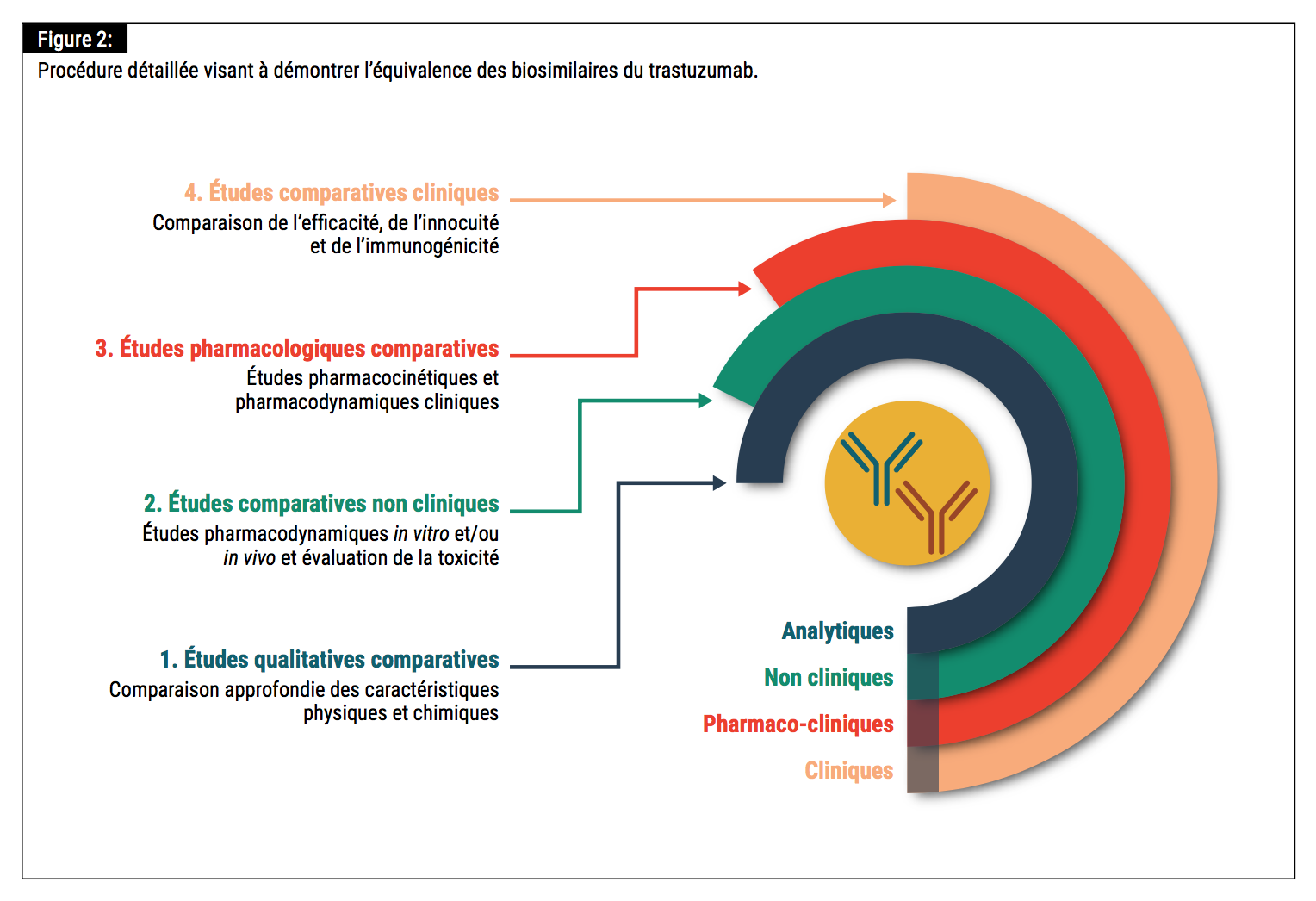
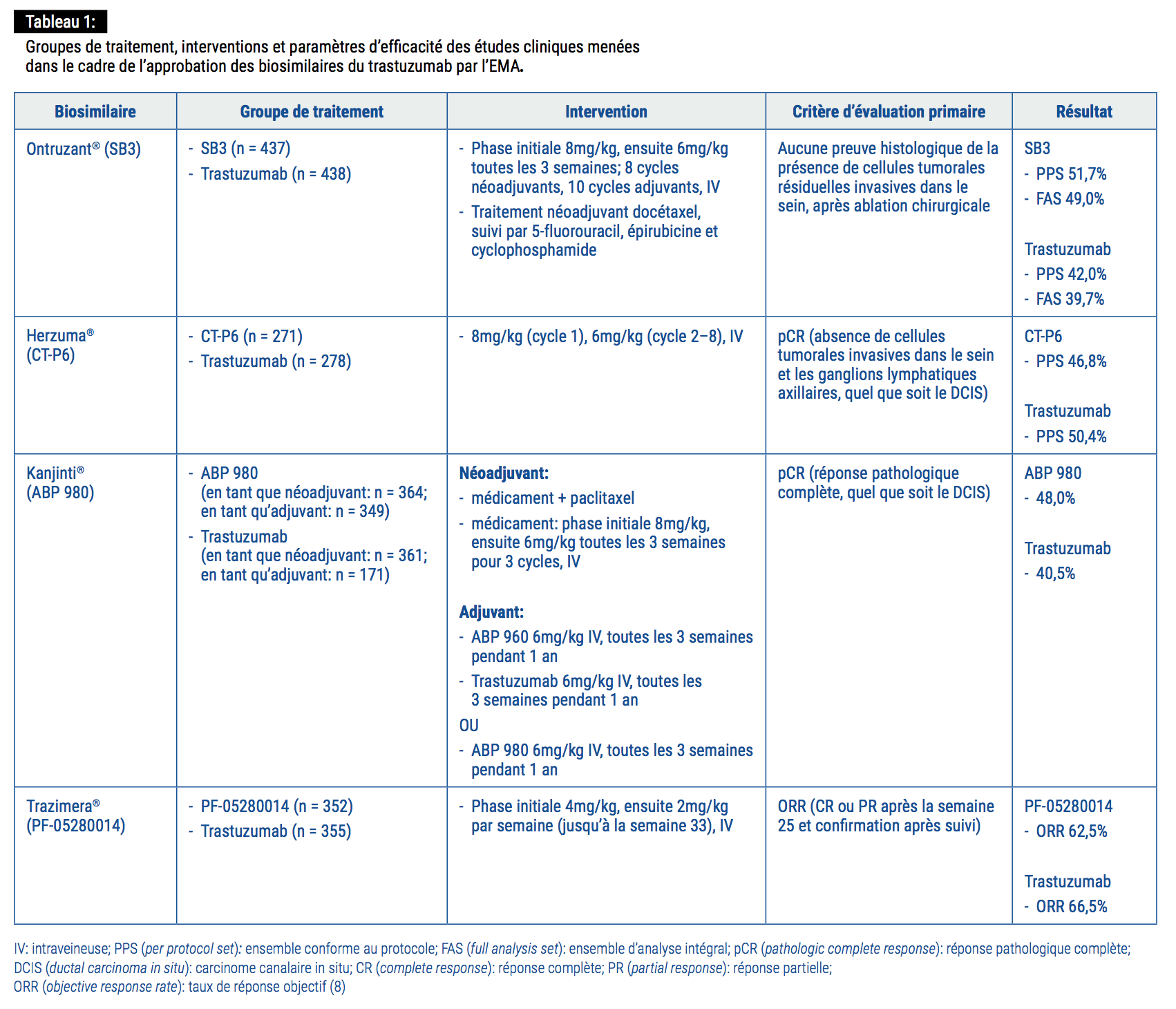
Les profils d’efficacité et d’innocuité des biosimilaires du trastuzumab ont été démontrés (dans un contexte comparatif head-to head avec le produit de référence) lors d’essais de phase III randomisés en double aveugle. Dans ces études, les critères d’évaluation primaires étaient le nombre de patientes présentant une réponse pathologique complète (pathologic complete response – pCR) (définie comme l’absence de cellules tumorales invasives dans le sein et les ganglions lymphatiques axillaires) en phase néoadjuvante et le taux de réponse globale (overall response rate – ORR) en cas de métastases. Les critères d’évaluation secondaires variaient d’une étude à l’autre, mais incluaient d’autres paramètres d’efficacité, tels que les taux de survie globale, sans événement et sans progression,
ainsi qu’une évaluation de l’innocuité et de l’immunogénicité du biosimilaire concerné.
Les biosimilaires suivants du trastuzumab sont désormais approuvés par l’EMA:
- Ontruzant® (SB3, Samsung Bioepis) est le premier biosimilaire du trastuzumab à avoir été approuvé en Europe, en novembre 2017. Des études cliniques ont démontré que le SB3 a un profil d’efficacité et d’innocuité équivalent, ainsi qu’une tolérabilité et une immunogénicité comparables à celles du produit de référence. Il a par conséquent été approuvé par l’EMA pour toutes les indications du trastuzumab, à savoir le cancer du sein HER2+ précoce et métastatique, et le cancer de l’estomac HER2+ métastatique (5);
- Herzuma® (CT-P6, Celltrion/Teva) a reçu l’avis favorable de l’EMA en février 2018 pour toutes les indications du trastuzumab (6);
- Kanjinti® (ABP 980, Amgen) a obtenu l’autorisation de l’EMA en mars 2018 pour toutes les indications du trastuzumab. Il y a peu, les résultats de l’étude multicentrique en double aveugle de phase III, LILAC, ont été publiés. Dans le cadre de cette étude, des femmes atteintes d’un cancer du sein HER2+ invasif de stade précoce ont été randomisées pour suivre un traitement par ABP 980 (n = 358) ou trastuzumab (n = 338).
Le critère d’évaluation primaire, à savoir une pCR, a été atteint chez 172 (48%), des patientes dans le bras ABP 980 contre 137 (42%) dans le bras trastuzumab. Des effets indésirables (> grade 3) lors de la phase néoadjuvante ont été relevés chez 15% des patientes dans le bras ABP 980 contre 14% dans le bras trastuzumab: la neutropénie (l’effet indésirable > grade 3 le plus souvent constaté) a été observée chez 6% des patientes dans les 2 cohortes (7);
- Trazimera® (PF-05280014, Pfizer) a été approuvé par l’EMA en mai 2018 pour toutes les indications du trastuzumab. Les résultats des études de phase III REFLECTIONS réalisées sur des patientes atteintes d’un cancer du sein HER2+ métastatique montrent un ORR de 62,0% pour Trazimera®, contre 66,5% pour le trastuzumab, ainsi qu’un profil d’innocuité équivalent et une incidence d’effets secondaires similaire.
À cet égard, il convient de noter que ces biosimilaires sont uniquement administrés par intraveineuse, alors que le trastuzumab peut être injecté par voie intraveineuse ou sous-cutanée. Autrement dit, le choix d’administrer le biosimilaire ou le produit de référence dépendra du contexte clinique précis (9). Qui plus est, les spécialistes s’attendent à ce que la liste susmentionnée s’allonge chaque année à mesure que d’autres biosimilaires du trastuzumab recevront l’autorisation de l’EMA. En effet, des études de phase III évaluant d’autres biosimilaires du trastuzumab ont été entamées ou sont déjà clôturées.